지난해보다 두 계단 상승.. 美 1위 이어 독일.영국 순
서울 임상시험 도시서 1위.. 환자 풀 많고 의료진 집중
서울 임상시험 도시서 1위.. 환자 풀 많고 의료진 집중
우리나라가 지난해 글로벌 임상시험 점유율 세계 6위에 오르며 역사상 최고 순위를 기록했다.
한국임상시험산업본부는 세계적 임상시험 레지스트리인 미국국립보건원(NIH) 홈페이지(ClinicalTrials.gov) 데이터를 분석한 결과 미국이 전체 점유율 24.5%를 차지하며 지난해에 이어 1위 자리를 지켰다고 15일 밝혔다. 이어 독일(5.3%), 영국(5.0%), 캐나다(3.9%), 중국(3.7%)이 뒤를 이었고 한국은 3.5%의 점유율로 6위를 차지했다.
이는 지난해 8위와 비교해 두 계단 상승한 것이다. 특히 서울은 전 세계 임상시험 도시 순위에서 1위를 기록했다. 2위인 미국의 휴스턴과 큰 격차를 보였다는 점에서 의미가 있다.
■글로벌 임상시험 규모 줄어도 한국은 선전
최근 글로벌 임상시험 규모는 새로운 신약 후보물질 감소와 신약 개발 효율성 저하에 따른 연구개발 투자비용 급증, 각국 보건 당국의 임상시험 및 신약허가 기준 강화 등으로 큰 폭으로 감소하고 있다. 실제 지난 2016년과 2017년의 글로벌 임상시험 건수는 각각 전년 대비 25.4%, 16.3% 줄었다.
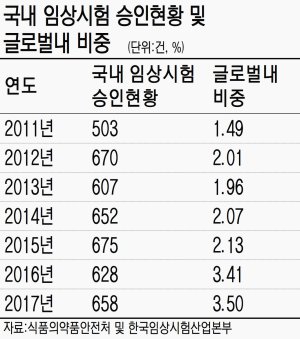
그러나 국내 임상시험 규모는 2017년 총 658건을 기록하며 지난 2011년 대비 약 31% 가량 상승했다. 글로벌 임상시험 건수에서 차지하는 비율도 2016년 3.41%에서 올해 3.5%로 커졌다. 국내 임상시험 규모는 2011년 503건을 시작으로 2012년 670건, 2013년 607건, 2014년 652건, 2015년 675건, 2016년 628건 등 꾸준한 상승세를 이어오고 있다.
특히 다국적 제약사가 주도하는 임상시험 규모는 2013년에는 248건을 기록한데 이어 2014년 285건, 2015년 296건, 2016년 267건으로 집계되면서 국내 임상시험 시장의 글로벌 경쟁력이 커졌다는 평가다. 같은 기간 국내 제약사가 주도한 임상시험은 2013년 248건, 2014년 285건, 2015년 296건, 2016년 267건으로 기록됐다.
■서울, 글로벌임상시험 1위 도시로 등극
우리나라의 글로벌 임상시험 증가는 국내 의료기관의 퀄리티가 높기 때문이다. 글로벌 제약사들은 지난 2000년 초반부터 본격적으로 한국에서 임상시험을 시작했다.
임영석 서울아산병원 임상시험센터 소장(소화기내과 교수)은 "글로벌 제약사가 임상시험을 진행할 때 가장 중요한 것은 신약의 유효성과 안전성을 입증하는 것"이라며 "또 비용절감도 중요하기 때문에 신약개발에 프로토콜에 맞는 환자를 빨리 등록해야하고 안전성 문제가 발생했을 때 이를 빨리 인지하고 대처한 후 보고하는 시스템이 잘 갖춰진 의료기관이어야 한다"고 설명했다.
이같은 요건을 갖춘 곳이 한국의 서울이라는 것이다.
서울의 대형 의료기관에는 전국 암환자의 35%가 등록이 돼 있다. 환자 풀도 그만큼 많고 의료진이 집중돼 있고 퀄리티가 높기 때문에 문제가 생겼을 때 대처 능력이 뛰어나다. 이 때문에 도시로 보면 서울의 임상건수가 세계에서 가장 많다. 또 임상시험을 진행할 때 의료기관의 퀄리티가 떨어지면 신약의 부작용이 아닌 임상기관의 실수로 신약개발 자체를 접을 수 있는 위험이 있기 때문이다.
임 소장은 "특히 2015년 이후에는 글로벌 제약사들이 최상위 의료기관에만 맡기는 임상 1b(1상중 환자대상 임상시험)가 크게 증가하고 있다는 점에서 고무적"이라며 "국내 의료기관이 글로벌 제약사들이 진행하는 글로벌 스탠다드 임상시험에 익숙해져 있기 때문에 국내 제약사들이 신약개발을 할 때 임상시험 인프라가 갖춰져 있다는 점에서 큰 경쟁력이 될 수 있을 것"이라고 전망했다.
한편, 정부의 정책지원도 국내 임상시험 규모 성장에 도움이 되고 있다. 지난해 보건복지부가 진행한 '제2차 제약산업 육성.지원 5개년 종합계획'이 긍정적으로 작용했다는 평가다.
지동현 한국임상시험산업본부 이사장은 "우리나라 임상시험의 선전은 임상시험 인프라와 수행 역량의 우수성을 입증하는 것"이라며 "정부 지원의 성과가 나타나는 만큼 국내 개발신약도 임상 3상까지 진행할 수 있도록 관.산.학의 임상개발 역량 제고와 규제 선진화, 인센티브 도입 등이 필요하다"고 강조했다.
juyong@fnnews.com 송주용 정명진 기자
※ 저작권자 ⓒ 파이낸셜뉴스, 무단전재-재배포 금지