
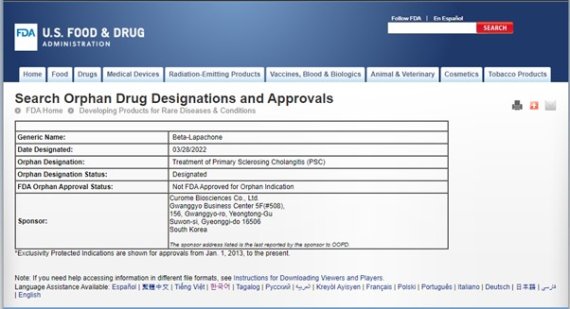
원발성 경화성 담관염은 원인모를 간내/간외 담도의 염증과 섬유화로 인해 발생되는 만성진행형 담즙 정체성 희귀 간질환으로서, 아직까지 전세계적으로 효과적인 치료제가 없는 상태이다.
‘HK-660S’는 안정성이 검증된 NAD+ 촉진제(Nicotinamide Adenine Dinucleotide [NAD+] booster) 로 세포 내 NAD+ 증진 기전의 항염증 및 항섬유화 경구용 치료제다. 원발성 경화성 담관염에 대한 효능은 PSC 동물모델에서 HK-660S의 투여가 PSC의 혈중 임상지표인 ALP를 감소시키고 간 조직내 항염증 및 항섬유화 효과를 발휘하는 것으로 확인된 바 있다.
윤주석 큐롬바이오사이언스 대표는 “이번 HK-660S의 FDA 희귀의약품 지정으로 원발성 경화성 담관염 치료제로의 개발 가능성을 확인했다”며, “현재 진행되고 있는 임상을 성공적으로 마무리하여 원발성 경화성 담관염 환자들에게 하루 빨리 치료제를 제공할 수 있기를 바란다” 라고 말했다.
FDA 희귀의약품 지정은 희귀질환 치료제의 개발 및 허가를 지원하기 위한 제도로서 세금 감면, 허가 신청 비용 면제와 제품발매가 이루어졌을 때 7년의 독점발매권 보장 등 갖가지 혜택과 인센티브를 제공받게 된다.
‘HK-660S’ 임상 2상은 2021년 식약처로부터 임상시험계획(IND)을 승인받아 2021년 11월 첫 대상자를 등록하여 서울소재 대형병원 2곳에서 활발하게 수행 중이다. 이에 대한 정보는 질병 관리청 임상연구 정보 서비스(등록번호: KCT0006590) 또는 식품의약품안전처 의약품통합정보시스템 임상시험 정보검색(제품명: HK-660S)에서 확인 가능하다.
※ 저작권자 ⓒ 파이낸셜뉴스, 무단전재-재배포 금지